Nano Res.[生物]│郑珍团队开发时空调控型肽-药物偶联物:肿瘤微环境触发形貌转变增强抗肿瘤免疫与转移抑制
本篇文章版权为郑珍课题组所有,未经授权禁止转载。

背景介绍
癌症免疫疗法作为继手术、放疗、化疗后的第四大肿瘤治疗模式,在黑色素瘤、非小细胞肺癌等适应症中展现出显著疗效。然而,其临床应用仍面临两大关键挑战:一方面,免疫检查点抑制剂单药治疗响应率普遍不足30%,存在原发性或获得性耐药问题;另一方面,与传统化疗药物联用时常因时空分布差异导致协同效果受限,且加剧全身毒性反应(如免疫相关性肺炎、结肠炎等)。
纳米技术为解决这一难题提供了新思路,其中基于肽的药物递送系统因其良好的生物相容性和结构可编程性等独特的生物学特性备受关注。然而,现有肽基递送系统仍存在动态调控不足的缺陷:传统纳米颗粒在完成药物递送后即解体,无法持续调节肿瘤免疫微环境。这导致免疫治疗药物在病灶部位滞留时间短,难以维持有效的治疗浓度。针对这一瓶颈,开发具有形态自适应能力的递送系统,实现化疗免疫协同的时空精准调控,成为当前研究的重要突破口。
成果简介
针对当前癌症治疗中化疗与免疫治疗协同不足的难题,本研究创新性地开发了一种具有肿瘤微环境响应特性的智能递送系统,为解决化疗与免疫治疗协同不足这一临床难题提供了新策略。该系统的突破性设计在于其可动态转换的"纳米球-纳米纤维"双形态结构:在体内循环阶段,肽-药物偶联物Ind-GFFYK-SN38可自组装形成100 nm左右的纳米颗粒,凭借增强渗透滞留效应(EPR效应)实现肿瘤组织的靶向富集;当进入肿瘤微环境后,在肿瘤特异性高表达的酯酶触发下,该系统发生精确的酶切响应,一方面释放强效化疗药物SN38(7-乙基-10-羟基喜树碱),另一方面剩余肽段GFFYK自组装形成三维纳米纤维网络。这种智能形貌转换具有多重治疗优势:1)显著延长免疫调节剂Indoximod的瘤内滞留时间;2)促进CD8+T细胞的大量浸润;3)通过物理屏障作用有效抑制肿瘤转移。该研究在单一制剂中实现了化疗与免疫治疗的时空协同,其设计理念为开发新型靶向联合疗法提供了可推广的技术平台。
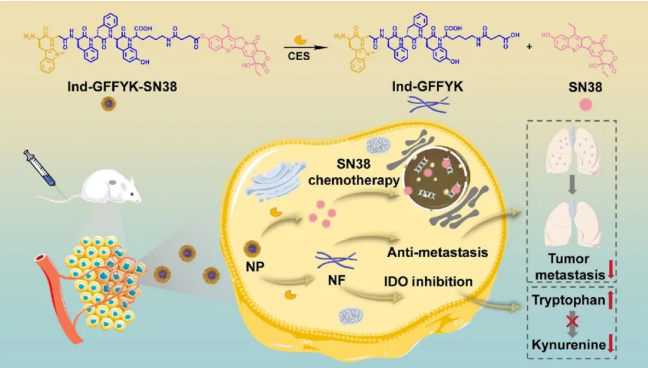
图1 治疗机制示意图(NP: 纳米颗粒; NF: 纳米纤维)。
通讯作者简介
郑珍,天津医科大学药学院,教授,博士生导师,天津市首批青年科技人才、天津医科大学杰出青年学者。2012年本科毕业于南京大学化学化工学院,2017年博士毕业于中国科学技术大学。2017年至2021年先后在美国俄亥俄州立大学和威斯康星大学麦迪逊分校开展博士后研究。2021年10月加入天津医科大学药学院,成立独立研究课题组,并任药物分析学系主任,研究方向为多肽创新药设计及其质控分析方法开发。近年来以通讯和第一作者身份发表业内高水平SCI研究论文20余篇,包括Advanced Science、Nano Today、J. Am. Chem. Soc.、Adv. Mater.等,并获得安徽省科学技术奖二等奖,中国科学院院长奖,第二届全国博士后创新创业大赛海外(境外)赛银奖等荣誉。2017年入选中国优秀青年学者代表团成员(全国20名),赴德参加第67届诺贝尔奖获得者大会。
该研究得到了天津市青年科技人才基金和国家自然科学基金等项目资助。

如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号