UCSF DeGrado团队和中科院张少庆团队JACS:从头设计Zn²⁺传感器蛋白驱动跨膜信号转导
在蛋白质设计领域,要凭空创造出能够响应外界刺激并进行变构信号传递的分子系统,无疑是一项重大挑战。跨膜信号传递是生物体感知外界刺激并触发细胞内反应的核心过程。在细菌中,组氨酸激酶(HK)作为双组分系统的关键组成部分,通过胞外结构域感知信号(如金属离子、代谢物等),并将构象变化传递至胞内催化结构域,最终通过磷酸化级联反应调控基因表达。然而,天然HK的信号特异性受限于其进化形成的传感器结构域,如何通过工程化手段重新设计传感器以实现用户定义的信号响应,一直是合成生物学和蛋白质工程领域的重大挑战。
尽管近年来蛋白质从头设计技术取得了显著进展(如设计离子通道、配体诱导的构象开关等),但在跨膜系统中实现多结构域协同信号传递仍面临两大难题:其一,传感器与跨膜结构域的热力学耦合。信号传递要求传感器结构域的构象变化能有效改变下游结构域的自由能(ΔG),但人工设计的传感器常因过度稳定或构象灵活性不足导致信号传导效率低下。其二,连接子(Linker)的优化。连接传感器与跨膜螺旋的连接子长度和相位(α螺旋周期性)直接影响信号传递的方向性和效率,但其设计规则尚不明确。那么,能否设计全新的蛋白质传感器模块,来构建组氨酸激酶这类复杂的信号转导系统呢?
近日,加州大学旧金山分校(UCSF)William F. DeGrado 团队和中国科学院分子细胞科学卓越创新中心张少庆团队发表研究论文,针对上述问题进行了深入探索。他们成功地从头设计了新型的Zn2+结合传感器结构域,并用其替换了天然跨膜组氨酸激酶中的传感器部分,由此构建的人工设计激酶能够有效地传递由这一全新传感器所启动的信号。
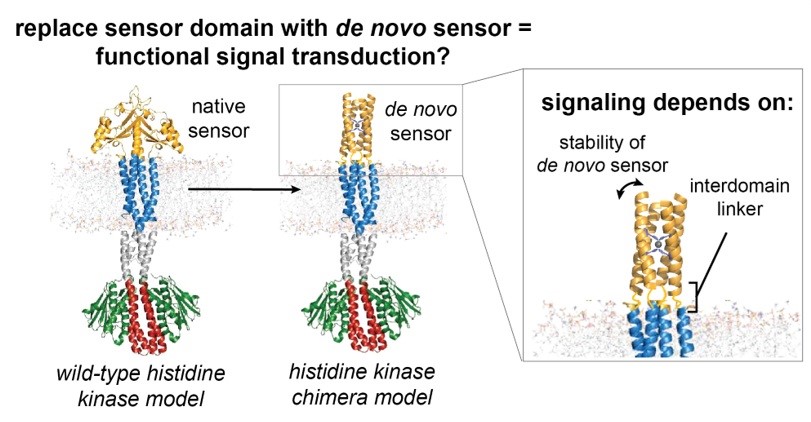
图1. 工作概览
这项工作首先基于张少庆和DeGrado先前设计的能结合Zn2+的四螺旋束蛋白 4EH2,通过引入螺旋间环区,将其改造为一个二聚体的Zn2+传感结构域 (Zn-sensorlong)。在此过程中,利用结构数据库和MASTER算法,筛选并引入了常见的helix-turn-helix环区,形成C2对称的二聚体结构,这一设计旨在模拟天然HK传感器中保守的、位于同源二聚体界面的周质螺旋。体外实验证实,该人工传感结构域能以纳摩尔级别的亲和力结合Zn2+,并在结合配体后展现出预期的结构特性。为了更接近天然信号系统,研究者还将Zn-sensorlong与GCN4二聚体融合,进一步确认其二聚体结构和高亲和力Zn2+结合能力。
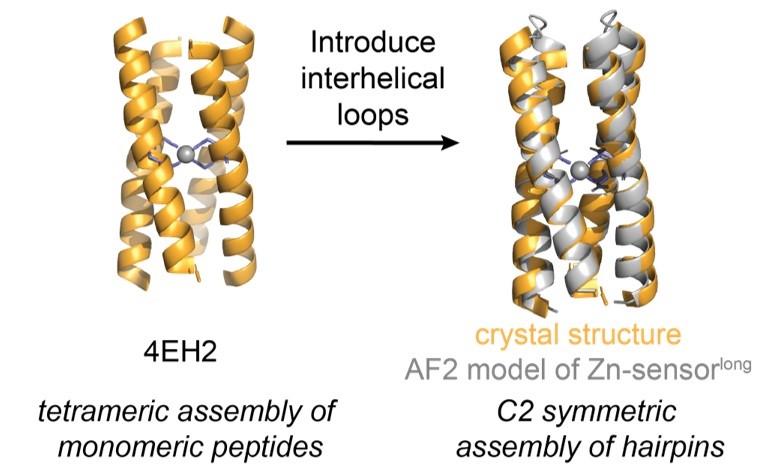
图2D. 金属结合蛋白4EH2由4个肽段组成的组装结构被改造为C2对称的螺旋-转角-螺旋结构组装体
接下来,将这个从头设计的 Zn-sensorlong 结构域替换了大肠杆菌 CpxA (一种组氨酸激酶) 的天然传感结构域,构建了嵌合蛋白。成功的信号转导不仅取决于传感结构域本身,还严重依赖于连接传感结构域和下游跨膜 (TM) 结构域的连接子的特性,如其长度和相位。研究团队系统地改变了连接 Zn-sensorlong 与 CpxA 跨膜螺旋的两个连接子 (Link1和 Link2) 的长度,并利用基于荧光报告基因的细胞筛选方法,评估了不同嵌合体的信号转导活性。结果显示,第二个连接子 (Link2) 的长度对基础信号活性呈现周期性影响,这与 α-螺旋的重复频率相似(3.6残基/圈)。
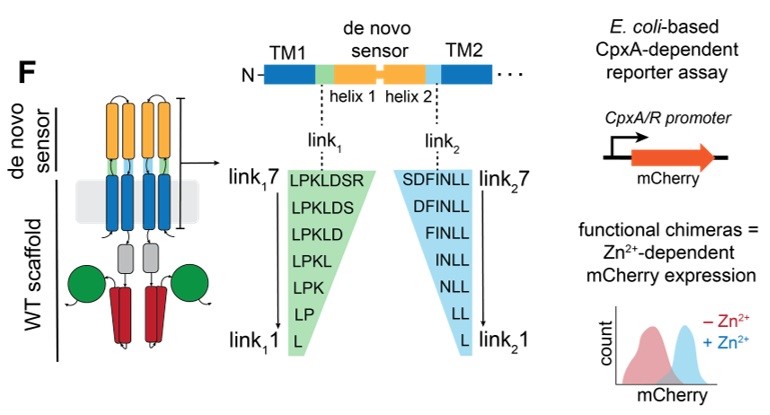
图2F. 不同连接子的嵌合体文库
可能是因为 Zn-sensorlong 结构过于稳定,即使在没有Zn2+的情况下也已处于一种预组织的状态,导致配体结合引发的构象变化不足以有效地传递信号。为了解决这个问题,通过截短传感结构域的螺旋,设计了两种稳定性降低的突变体:Zn-sensortop(在结合位点上方截短) 和 Zn-sensorbottom (在结合位点下方、更靠近跨膜区的位置截短)。理论上,降低传感结构域的稳定性,可以使得配体结合时产生更大的构象和能量变化,从而增强信号的动态范围。实验结果支持了这一假设:特别是 Zn-sensorbottom 突变体,其结合位点更靠近跨膜结构域且预组织程度较低,在与不同长度连接子组合后,多个嵌合体表现出显著增强的Zn2+ 依赖性信号转导,且响应更为均一。值得注意的是,Zn-sensorbottom 突变体在细胞群体水平上展现出更一致、更强烈的Zn2+依赖性响应,动态范围媲美甚至超过了天然激酶,说明“预组织程度”是人工信号系统设计的重要调控参数。
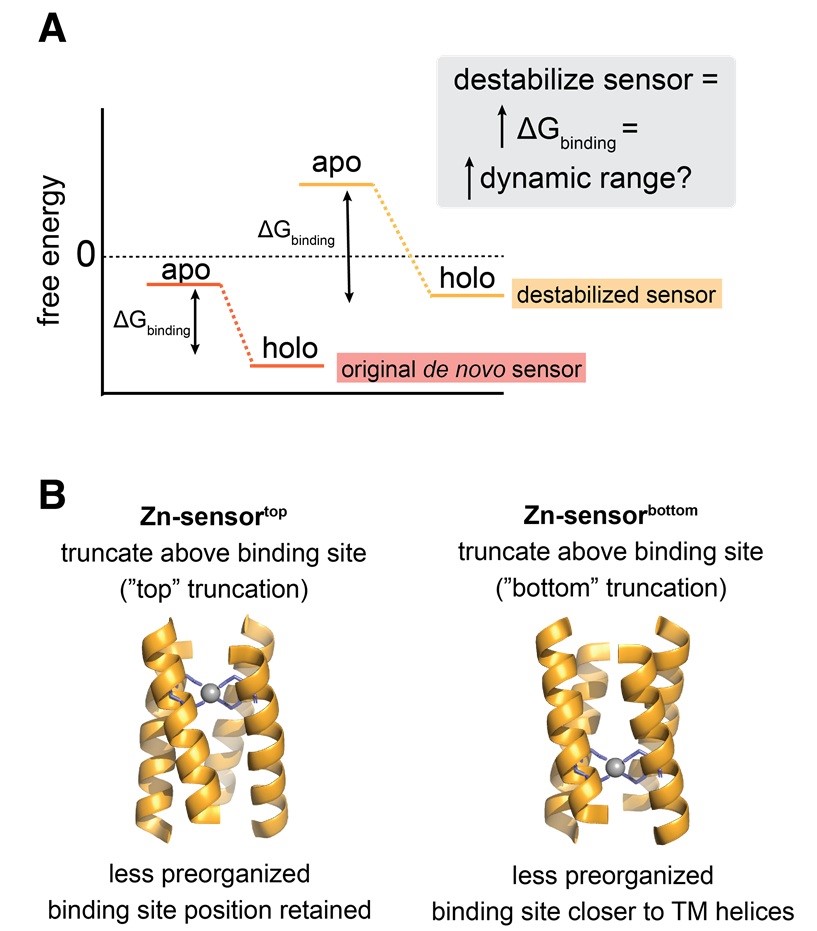
图3. 增大传感器结合Zn2+前后自由能变化扩大受体的动态信号响应范围
在金属离子特异性方面,体外实验和细胞水平测定均显示,Zn2+的结合和信号响应最强,Ni2+和Co2+次之,Mn2+基本无响应。细胞中的信号响应浓度高于体外亲和力,这与天然系统类似,反映出信号通路中的能量耦合机制,即部分结合能被用于推动多结构域的构象转换,实现“开关”功能。
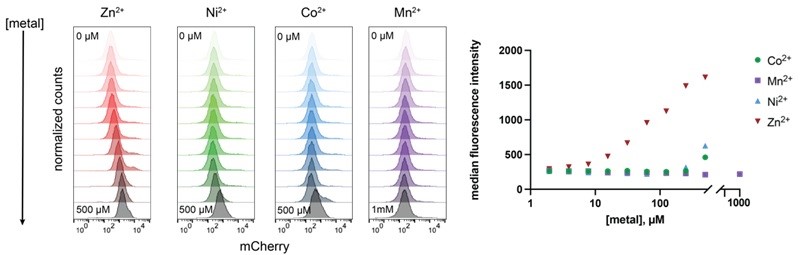
图4. 最优嵌合体对不同二价金属离子的剂量响应曲线及选择性
这项工作首次将热力学耦合模型应用于从头设计的跨膜系统,证实了能量传递的层级性——传感器结构域的构象变化需通过连接子传递至跨膜螺旋,并逐级影响胞内催化结构域的磷酸化活性。还揭示了“预组织化”陷阱的规避:过度稳定的传感器(如Zn-sensorlong)因构象刚性导致ΔG变化不足,而适度截短(如Zn-sensorbottom)通过降低预组织化程度,释放了构象变化的自由度。此外,研究还建议,未来可借助AI结构预测工具(如AlphaFold或Chai-1)预先筛选嵌合体结构,减少实验筛选压力。通过对连接子序列、传感器稳定性和结合位点几何的进一步理性优化,以及对报告基因启动子的工程化改造,有望进一步拓展和优化这类人工信号系统的响应范围和特异性。
这项工作的第一作者是A. Katherine Hatstat博士,通讯作者是William F. DeGrado教授、张少庆研究员、A. Katherine Hatstat博士。张少庆团队在此项工作中得到了国家重点研发计划(2024YFA0916800)和国家自然科学基金面上项目(22177113)的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A Designed Zn2+ Sensor Domain Transmits Binding Information to Transmembrane Histidine Kinases
A. Katherine Hatstat*, Rian Kormos, Vee Xu, Guoming Du, Lijun Liu, Shao-Qing Zhang*, William F. DeGrado*
J. Am. Chem. Soc., 2025, DOI: 10.1021/jacs.5c02273
招聘信息
张少庆团队长期招聘蛋白质设计和生物医学技术开发博士后和科研助理,详情参见:https://zhanglab.sibcb.ac.cn/zhanglab/recruit.html
张少庆团队
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号