南京农大陈世国AS: 揭示一种新型Tetramic acid类天然产物的生物合成途径及机制
本文来源于Advanced Science, 欢迎浏览!
论文信息

研究背景
Tetramic acid(含2,4-吡咯烷二酮)是天然产物中最常见、活性最广、最受关注的化合物之一,其中典型代表是细交链格孢菌酮酸(tenuazonic acid, TeA)。Sec-pentyl-tenuazonic acid(S-TeA)是以TeA为先导设计和合成的一个新
,比TeA具有更高的除草活性。然而,与化学农药相比,天然产物在农药的产业化及登记过程中更具优势和吸引力。因此,明确S-TeA是否是天然产物、解析其生物合成途径及机制对于实现其产业化具有十分重要的意义。
文章概述
近日,南京农业大学生命科学学院陈世国教授课题组发现S-TeA是一种新型Tetramic acid类天然产物,并解析了其生物合成途径和机制。相关成果发表在Advanced Science上。
本研究中,首先通过分离纯化和结构鉴定确认S-TeA是一种天然产物,并明确了天然S-TeA的绝对构型为 (5S, 6S),这为将S-TeA开发成生物除草剂提供了科学依据。同时,本研究利用多组学、同位素示踪、质谱、蛋白重组等手段明确了S-TeA是以苏氨酸为起始原料,先通过支链氨基酸合成途径中8个酶在线粒体中合成直接前体AMHA(2-氨基-3-甲基己酸),随后AMHA在细胞质中被NRPS-PKS(非核糖体肽合成酶-聚酮合酶)乙酰化和环化形成S-TeA,最后通过跨膜蛋白AaMFS1将S-TeA排到胞外的合成机制。其中,2-异丙基苹果酸合成酶(IPMS),3-异丙基苹果酸脱水酶(IPMDH)和异丙基苹果酸脱氢酶(ISMD)是AMHA生物合成途径特有的酶,而IPMDH是关键限速酶。AMHA已经被证实是一种天然发生的非蛋白氨基酸,具有抗逆、促生、提质、缓解药害等功能,已获得多项发明专利授权和新农药命名“氨甲己酸”,有潜力开发成我国具有完全自主知识产权的植物诱抗剂新产品。本研究对真菌中AMHA生物合成途径及机制的解析,为基于合成生物学构建AMHA高产工程菌株、实现其高效生物制造奠定了坚实的理论基础。
图文导读

图1. A. alternata 中S-TeA的分离纯化和化学结构鉴定及不同丝状真菌中S-TeA的定量分析。(A)A. alternata发酵液中S-TeA的分离纯化;(B)纯化后的S-TeA在常温下的形态;(C-G)S-TeA的结构解析;(H)A. alternata中S-TeA与TeA的含量比较;(I)不同TeA产生菌中S-TeA的含量。
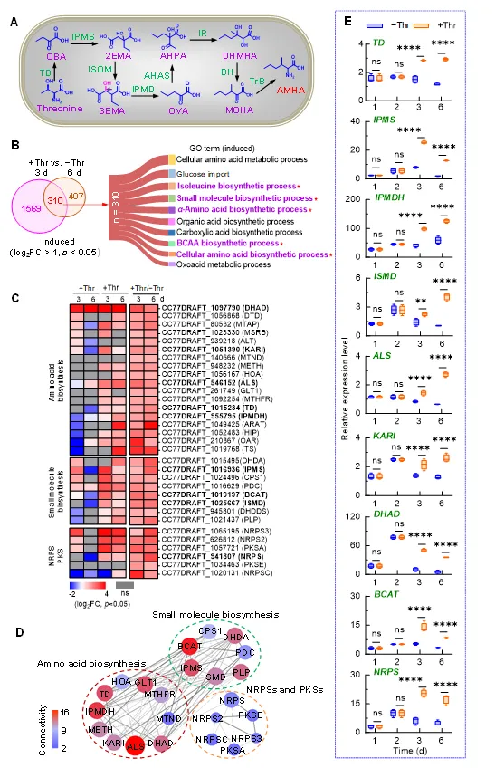
图2. A. alternata中S-TeA生物合成的关键基因解析。(A)大肠杆菌中AMHA的可能生物合成途径。(B-C)转录组测序明确S-TeA生物合成的关键代谢通路及基因;(D)S-TeA生物合成途径中关键酶的蛋白关系网络;(D)S-TeA生物合成的关键基因的表达水平。
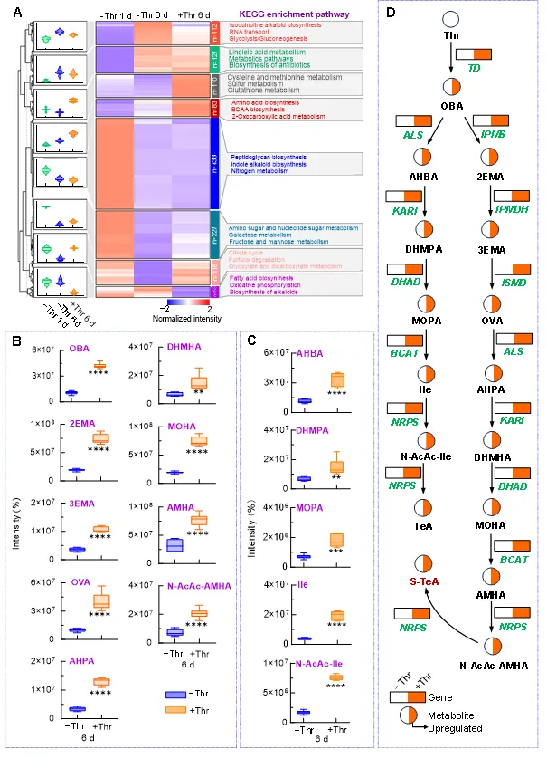
图3. A. alternata中S-TeA生物合成的关键代谢物。(A-C)非靶向代谢组解析S-TeA生物合成途径的关键代谢步骤及代谢物;(D)基于转录组和非靶向代谢组建立的S-TeA与TeA的生物合成途径。
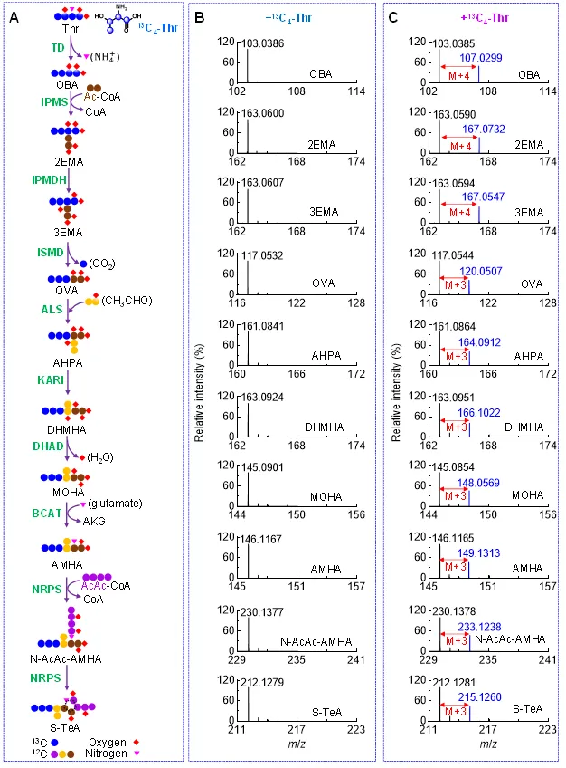
图4. 稳定同位素示踪技术证实S-TeA生物合成途径的关键步骤。(A)基于13C4-苏氨酸喂养A. alternata预测的S-TeA生物合成途径中关键代谢物的碳原子标记形式;(B)未标记苏氨酸喂养A. alternata(−13C4-Thr),S-TeA生物合成途径中关键代谢物的一级质谱图;(C)13C4-苏氨酸喂养A. alternata(+13C4-Thr),S-TeA生物合成途径中关键代谢物的一级质谱图。
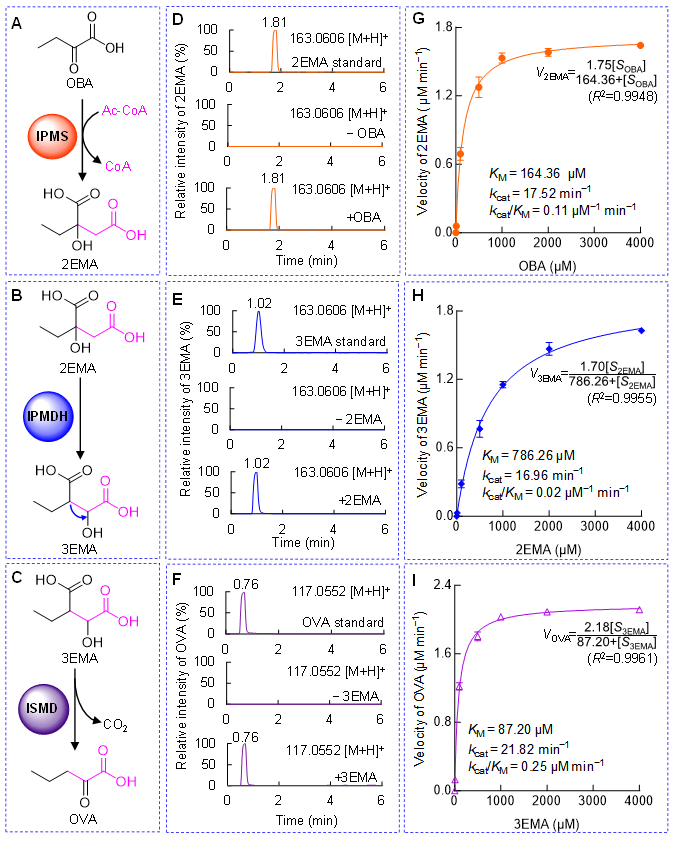
图5. S-TeA生物合成途径中的三种重要酶:IPMS,IPMDH和ISMD与相应底物OBA,2EMA和3EMA的体外生化分析。(A-C)三种酶的酶促反应示意图;(D-F)三种酶催化相应底物的UPLC-MS离子流图;(G-I)三种酶催化对应底物的Michaelis-Menten方程及关键酶促动力学参数。
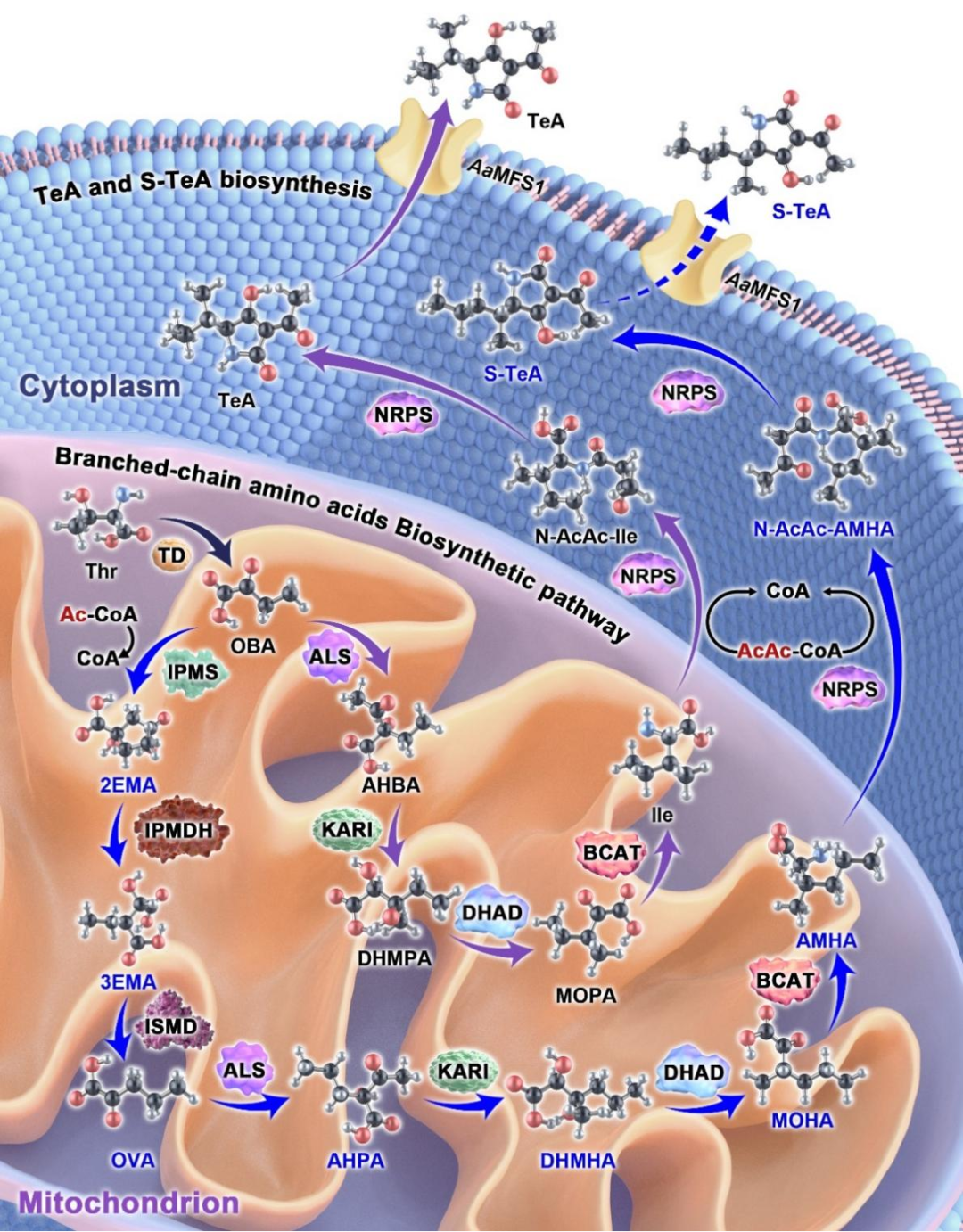
图6. 真菌A. alternata生物合成AMHA及S-TeA的路径及机制
期刊简介
Advanced Science 是Wiley旗下创刊于2014年的优质开源期刊,发表材料科学、物理化学、生物医药、工程等各领域的创新成果与前沿进展。期刊为致力于最大程度地向公众传播科研成果,所有文章均可免费获取。被Medline收录,PubMed可查。最新影响因子为17.521,中科院2021年SCI期刊分区材料科学大类Q1区、工程技术大类Q1区。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号